Номер 5, страница 69 - гдз по химии 8 класс сборник контрольных и самостоятельных работ Сеген, Власовец

Авторы: Сеген Е. А., Власовец Е. Н., Гарбар Е. Е., Синявская Т. С.
Тип: Сборник контрольных и самостоятельных работ
Издательство: Аверсэв
Год издания: 2019 - 2025
Цвет обложки: оранжевый с колбой
ISBN: 978-985-19-4532-6
Рекомендовано Научно-методическим учреждением "Национальный институт образования" Министерства образования Республики Беларусь
Популярные ГДЗ в 8 классе
Самостоятельная работа 12. По теме «Химическая связь. Окислительно-восстановительные реакции». Вариант 2. Вариант 2 - номер 5, страница 69.
№5 (с. 69)
Решение. №5 (с. 69)
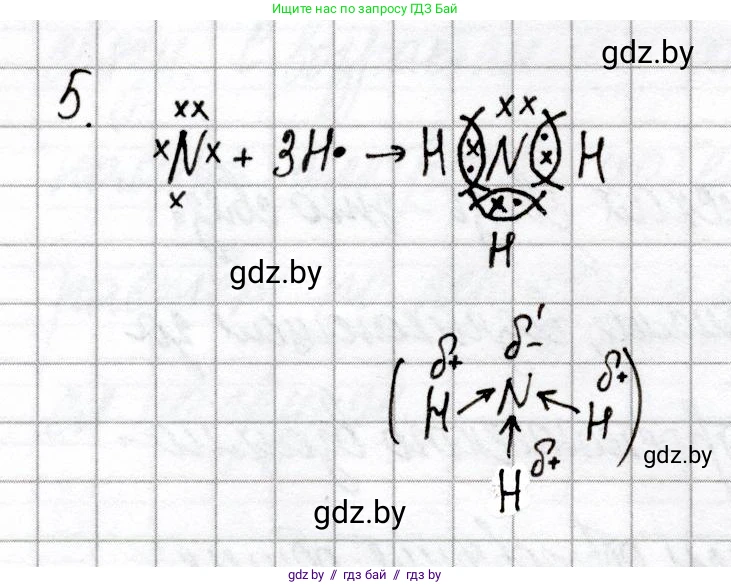
Решение 2. №5 (с. 69)
Для решения задачи необходимо определить химический элемент по его атомному номеру, затем установить формулу его летучего водородного соединения, составить схему образования связи в этой молекуле и указать направление смещения электронной плотности.
Определение элемента и его летучего водородного соединения
Элемент с атомным номером 7 - это Азот ($ \mathrm{N} $). Он находится во 2-м периоде, V группе главной подгруппы (группа 15) Периодической системы химических элементов Д.И. Менделеева. Электронная конфигурация атома азота: $ 1s^2 2s^2 2p^3 $. На внешнем энергетическом уровне атом азота имеет 5 электронов (2s² 2p³). Для завершения внешней электронной оболочки (до стабильного октета) атому азота необходимо 3 электрона.
Летучее водородное соединение азота - это аммиак, $ \mathrm{NH_3} $. В этой молекуле атом азота образует 3 ковалентные связи с тремя атомами водорода, предоставляя каждому водороду по одному электрону и принимая от каждого водорода по одному электрону. При этом на атоме азота остается одна неподеленная электронная пара.
Ответ: Элемент - Азот ($ \mathrm{N} $), его летучее водородное соединение - Аммиак ($ \mathrm{NH_3} $).
Схема образования химической связи в молекуле летучего водородного соединения, образованного элементом с атомным номером 7
Атом Азота ($ \mathrm{N} $): $ Z=7 $, электронная конфигурация $ 1s^2 2s^2 2p^3 $. Валентные электроны: 5. Атом имеет три неспаренных электрона в 2p-орбиталях, которые могут участвовать в образовании ковалентных связей, и одну неподеленную электронную пару на 2s-орбитали.
Атом Водорода ($ \mathrm{H} $): $ Z=1 $, электронная конфигурация $ 1s^1 $. Валентный электрон: 1.
Схема образования ковалентных связей в $ \mathrm{NH_3} $ (по Льюису):
$ \text{3H} \cdot \quad + \quad \overset{\cdot \cdot}{\underset{\cdot}{\mathrm{N}}} \cdot \quad \rightarrow \quad \text{H} \colon \underset{\text{H}}{\overset{\cdot \cdot}{\mathrm{N}}} \colon \text{H} $
Или в структурной формуле, где черта обозначает ковалентную связь (общую электронную пару):
$ \text{H} - \underset{\text{H}}{\overset{\cdot \cdot}{\mathrm{N}}} - \text{H} $
Атом азота в молекуле аммиака имеет 8 электронов на внешней оболочке (3 общие электронные пары и 1 неподеленная электронная пара), а каждый атом водорода имеет по 2 электрона (одну общую электронную пару), что соответствует стабильным электронным конфигурациям (октету для азота и дублету для водорода).
Ответ: Схема образования связи в молекуле $ \mathrm{NH_3} $ показана выше.
Направление смещения электронной плотности
Направление смещения электронной плотности в ковалентной связи определяется разностью электроотрицательностей атомов. Электроотрицательность (ЭО) по Полингу:
$ \text{ЭО(N)} \approx 3.04 $
$ \text{ЭО(H)} \approx 2.20 $
Так как электроотрицательность атома азота (3.04) значительно выше электроотрицательности атома водорода (2.20), общие электронные пары в связях N-H смещаются в сторону более электроотрицательного атома азота. Это приводит к появлению частичного отрицательного заряда ($ \delta^- $) на атоме азота и частичных положительных зарядов ($ \delta^+ $) на атомах водорода.
Направление смещения электронной плотности в каждой связи N-H можно показать стрелкой от атома водорода к атому азота:
$ \overset{\delta^+}{\mathrm{H}} \rightarrow \overset{\delta^-}{\mathrm{N}} \leftarrow \overset{\delta^+}{\mathrm{H}} $
$ \quad \quad \quad \quad \quad \uparrow $
$ \quad \quad \quad \quad \quad \overset{\delta^+}{\mathrm{H}} $
Молекула аммиака имеет пирамидальную форму с атомом азота в вершине и тремя атомами водорода в основании. Из-за полярности связей N-H и наличия неподеленной электронной пары на атоме азота, молекула аммиака является полярной, и её суммарный дипольный момент направлен от атомов водорода к атому азота.
Ответ: Электронная плотность смещается от атомов водорода к атому азота.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 5 расположенного на странице 69 к сборнику контрольных и самостоятельных работ 2019 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №5 (с. 69), авторов: Сеген (Елена Адамовна), Власовец (Евгения Николаевна), Гарбар (Елена Евгеньевна), Синявская (Тамара Степановна), учебного пособия издательства Аверсэв.













