Номер 2, страница 179 - гдз по химии 8 класс учебник Шиманович, Красицкий

Авторы: Шиманович И. Е., Красицкий В. А., Сечко О. И., Хвалюк В. Н.
Тип: Учебник
Издательство: Адукацыя i выхаванне
Год издания: 2024 - 2025
Цвет обложки: синий, розовый с таблицей Менделеева
ISBN: 978-985-03-2941-7
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 8 классе
Глава 5. Химическая связь. Параграф 42. Ковалентная связь - номер 2, страница 179.
№2 (с. 179)
Условие. №2 (с. 179)
скриншот условия

2. Составьте электронные схемы образования ковалентной связи в молекулах
$F_2$ и $Cl_2$
Решение. №2 (с. 179)
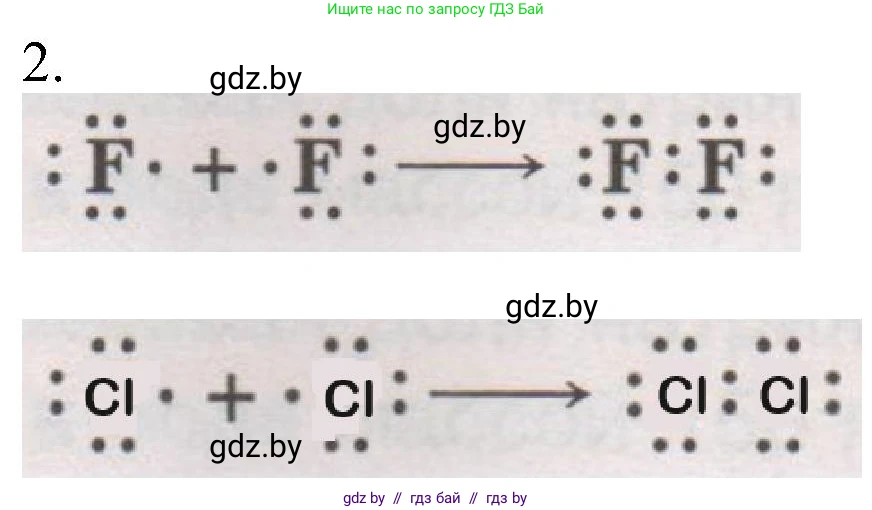
Решение 2. №2 (с. 179)
$F_2$
Атом фтора (F) — это элемент 17-й группы (VIIA подгруппы), 2-го периода периодической системы. Его порядковый номер – 9. Электронная конфигурация атома фтора: $1s^22s^22p^5$. На внешнем электронном слое у фтора находится 7 валентных электронов (три электронные пары и один неспаренный электрон).
Для достижения стабильной восьмиэлектронной конфигурации (октета), как у благородного газа неона, атому фтора не хватает одного электрона. При образовании молекулы $F_2$ два атома фтора сближаются, и каждый из них предоставляет по одному неспаренному электрону для образования общей электронной пары. Эта общая пара электронов принадлежит обоим атомам в равной степени и образует ковалентную неполярную одинарную связь.
Электронная схема образования связи выглядит следующим образом, где точками обозначены валентные электроны:
$:\overset{..}{\underset{..}{F}}\cdot + \cdot \overset{..}{\underset{..}{F}}: \longrightarrow :\overset{..}{\underset{..}{F}}:\overset{..}{\underset{..}{F}}:$
Ответ: В молекуле фтора ($F_2$) два атома фтора образуют ковалентную неполярную связь, обобществив по одному валентному электрону для создания одной общей электронной пары. В результате каждый атом фтора имеет по 3 неподеленные электронные пары и одну общую пару, что завершает его внешний электронный слой до октета. Электронная схема: $:\overset{..}{\underset{..}{F}}\cdot + \cdot \overset{..}{\underset{..}{F}}: \longrightarrow :\overset{..}{\underset{..}{F}}:\overset{..}{\underset{..}{F}}:$.
$Cl_2$
Атом хлора (Cl) также является галогеном и находится в 17-й группе (VIIA подгруппе), но в 3-м периоде. Его порядковый номер – 17. Электронная конфигурация атома хлора: $1s^22s^22p^63s^23p^5$. На внешнем (валентном) слое у него, как и у фтора, находится 7 электронов.
Подобно фтору, атому хлора для завершения внешнего слоя до октета (достижения стабильной конфигурации аргона) не хватает одного электрона. Поэтому механизм образования связи в молекуле хлора $Cl_2$ аналогичен молекуле фтора. Два атома хлора сближаются и образуют одну общую электронную пару за счет своих неспаренных валентных электронов, формируя ковалентную неполярную связь.
Электронная схема образования связи:
$:\overset{..}{\underset{..}{Cl}}\cdot + \cdot \overset{..}{\underset{..}{Cl}}: \longrightarrow :\overset{..}{\underset{..}{Cl}}:\overset{..}{\underset{..}{Cl}}:$
Ответ: В молекуле хлора ($Cl_2$) два атома хлора формируют ковалентную неполярную одинарную связь, предоставив по одному электрону для образования общей связывающей пары. Это позволяет каждому атому хлора достичь стабильной восьмиэлектронной оболочки. Электронная схема: $:\overset{..}{\underset{..}{Cl}}\cdot + \cdot \overset{..}{\underset{..}{Cl}}: \longrightarrow :\overset{..}{\underset{..}{Cl}}:\overset{..}{\underset{..}{Cl}}:$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 2 расположенного на странице 179 к учебнику 2024 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №2 (с. 179), авторов: Шиманович (Игорь Евгеньевич), Красицкий (Василий Анатольевич), Сечко (Ольга Ивановна), Хвалюк (Виктор Николаевич), учебного пособия издательства Адукацыя i выхаванне.













