Номер 9, страница 59 - гдз по химии 8 класс учебник Шиманович, Красицкий

Авторы: Шиманович И. Е., Красицкий В. А., Сечко О. И., Хвалюк В. Н.
Тип: Учебник
Издательство: Адукацыя i выхаванне
Год издания: 2024 - 2025
Цвет обложки: синий, розовый с таблицей Менделеева
ISBN: 978-985-03-2941-7
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 8 классе
Глава 2. Важнейшие классы неорганических соединений. Параграф 13. Химические свойства кислотных оксидов - номер 9, страница 59.
№9 (с. 59)
Условие. №9 (с. 59)
скриншот условия

9. В результате взаимодействия кислотного и основного оксидов образовалась соль фосфат магния массой 91,7 г. Рассчитайте массы прореагировавших оксидов.
Решение. №9 (с. 59)
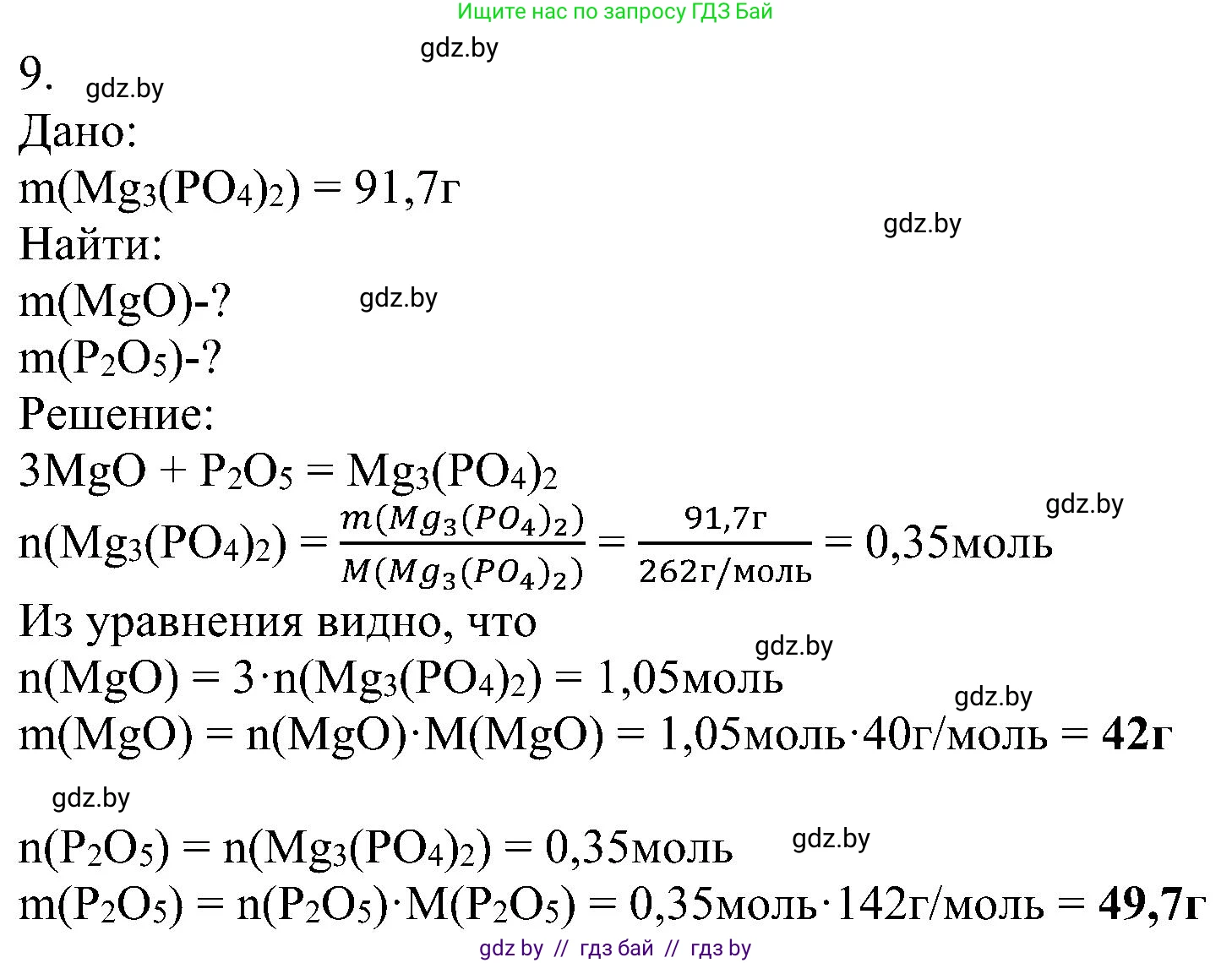
Решение 2. №9 (с. 59)
Дано:
$m(Mg_3(PO_4)_2) = 91,7 \text{ г}$
Найти:
$m(MgO) - ?$
$m(P_2O_5) - ?$
Решение:
Соль фосфат магния ($Mg_3(PO_4)_2$) является продуктом взаимодействия основного оксида и кислотного оксида. Основным оксидом, соответствующим катиону магния $Mg^{2+}$, является оксид магния $MgO$. Кислотным оксидом, соответствующим фосфат-аниону $PO_4^{3-}$, является оксид фосфора(V) $P_2O_5$.
1. Запишем уравнение химической реакции и расставим коэффициенты:
$3MgO + P_2O_5 \rightarrow Mg_3(PO_4)_2$
2. Вычислим молярные массы веществ, участвующих в реакции. Используем относительные атомные массы элементов из периодической таблицы (округляя до целых): $Ar(Mg) = 24$, $Ar(P) = 31$, $Ar(O) = 16$.
Молярная масса оксида магния ($MgO$):
$M(MgO) = 24 + 16 = 40 \text{ г/моль}$
Молярная масса оксида фосфора(V) ($P_2O_5$):
$M(P_2O_5) = 2 \cdot 31 + 5 \cdot 16 = 62 + 80 = 142 \text{ г/моль}$
Молярная масса фосфата магния ($Mg_3(PO_4)_2$):
$M(Mg_3(PO_4)_2) = 3 \cdot 24 + 2 \cdot (31 + 4 \cdot 16) = 72 + 2 \cdot (31 + 64) = 72 + 2 \cdot 95 = 72 + 190 = 262 \text{ г/моль}$
3. Найдем количество вещества (в молях) образовавшегося фосфата магния, используя формулу $n = \frac{m}{M}$:
$n(Mg_3(PO_4)_2) = \frac{m(Mg_3(PO_4)_2)}{M(Mg_3(PO_4)_2)} = \frac{91,7 \text{ г}}{262 \text{ г/моль}} = 0,35 \text{ моль}$
4. Используя стехиометрические коэффициенты в уравнении реакции, найдем количество вещества прореагировавших оксидов.
Из уравнения реакции следует, что соотношение количеств веществ равно:
$n(MgO) : n(P_2O_5) : n(Mg_3(PO_4)_2) = 3 : 1 : 1$
Следовательно, количество вещества оксида магния:
$n(MgO) = 3 \cdot n(Mg_3(PO_4)_2) = 3 \cdot 0,35 \text{ моль} = 1,05 \text{ моль}$
Количество вещества оксида фосфора(V):
$n(P_2O_5) = 1 \cdot n(Mg_3(PO_4)_2) = 0,35 \text{ моль}$
5. Рассчитаем массы прореагировавших оксидов по формуле $m = n \cdot M$:
Масса оксида магния:
$m(MgO) = n(MgO) \cdot M(MgO) = 1,05 \text{ моль} \cdot 40 \text{ г/моль} = 42 \text{ г}$
Масса оксида фосфора(V):
$m(P_2O_5) = n(P_2O_5) \cdot M(P_2O_5) = 0,35 \text{ моль} \cdot 142 \text{ г/моль} = 49,7 \text{ г}$
Для проверки можно сложить массы реагентов: $42 \text{ г} + 49,7 \text{ г} = 91,7 \text{ г}$. Эта сумма равна массе продукта, что соответствует закону сохранения массы.
Ответ: масса прореагировавшего оксида магния $m(MgO) = 42 \text{ г}$, масса прореагировавшего оксида фосфора(V) $m(P_2O_5) = 49,7 \text{ г}$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 9 расположенного на странице 59 к учебнику 2024 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №9 (с. 59), авторов: Шиманович (Игорь Евгеньевич), Красицкий (Василий Анатольевич), Сечко (Ольга Ивановна), Хвалюк (Виктор Николаевич), учебного пособия издательства Адукацыя i выхаванне.













