Номер 2, страница 181 - гдз по химии 8 класс учебник Шиманович, Красицкий

Авторы: Шиманович И. Е., Красицкий В. А., Сечко О. И., Хвалюк В. Н.
Тип: Учебник
Издательство: Адукацыя i выхаванне
Год издания: 2024 - 2025
Цвет обложки: синий, розовый с таблицей Менделеева
ISBN: 978-985-03-2941-7
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 8 классе
Глава 5. Химическая связь. Параграф 43. Одинарные и кратные связи - номер 2, страница 181.
№2 (с. 181)
Условие. №2 (с. 181)
скриншот условия
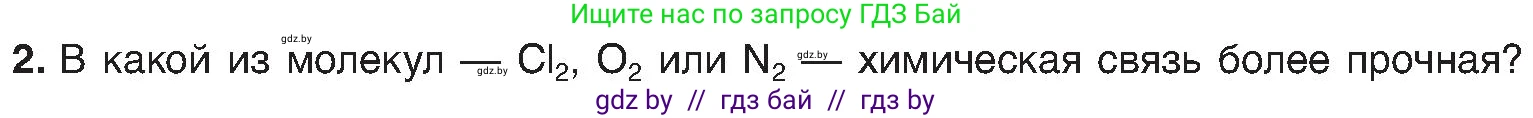
2. В какой из молекул — $ \text{Cl}_2 $, $ \text{O}_2 $ или $ \text{N}_2 $ — химическая связь более прочная?
Решение. №2 (с. 181)

Решение 2. №2 (с. 181)
Решение
Прочность химической связи определяется энергией, которую необходимо затратить для ее разрыва. Для ковалентных связей, образованных атомами одного и того же элемента, одним из ключевых факторов, влияющих на прочность, является кратность связи — число общих электронных пар между атомами. Чем выше кратность связи, тем короче и прочнее связь.
Рассмотрим строение предложенных молекул:
Молекула хлора $Cl_2$. Атом хлора находится в 17-й группе и имеет 7 валентных электронов. Для завершения внешней электронной оболочки до октета двум атомам хлора достаточно образовать одну общую электронную пару. Таким образом, в молекуле хлора существует одинарная ковалентная неполярная связь: $Cl-Cl$. Кратность связи равна 1. Энергия разрыва этой связи составляет $243$ кДж/моль.
Молекула кислорода $O_2$. Атом кислорода находится в 16-й группе и имеет 6 валентных электронов. Для достижения октета два атома кислорода образуют две общие электронные пары, формируя двойную связь: $O=O$. Кратность связи равна 2. Энергия разрыва этой связи значительно выше и составляет $498$ кДж/моль.
Молекула азота $N_2$. Атом азота находится в 15-й группе и имеет 5 валентных электронов. Для получения стабильной восьмиэлектронной оболочки два атома азота обобществляют три пары электронов, образуя тройную связь: $N \equiv N$. Кратность связи равна 3. Эта связь является одной из самых прочных в химии, ее энергия разрыва составляет $945$ кДж/моль.
Сравнивая кратности связей и их энергии, мы видим четкую зависимость: прочность связи растет с увеличением ее кратности. Ряд по увеличению прочности связи выглядит следующим образом: $Cl_2 < O_2 < N_2$.
Ответ: Наиболее прочная химическая связь в молекуле азота ($N_2$), так как она является тройной.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 2 расположенного на странице 181 к учебнику 2024 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №2 (с. 181), авторов: Шиманович (Игорь Евгеньевич), Красицкий (Василий Анатольевич), Сечко (Ольга Ивановна), Хвалюк (Виктор Николаевич), учебного пособия издательства Адукацыя i выхаванне.













