Практическая работа 3, страница 171 - гдз по химии 8 класс учебник Шиманович, Красицкий

Авторы: Шиманович И. Е., Красицкий В. А., Сечко О. И., Хвалюк В. Н.
Тип: Учебник
Издательство: Адукацыя i выхаванне
Год издания: 2024 - 2025
Цвет обложки: синий, розовый с таблицей Менделеева
ISBN: 978-985-03-2941-7
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 8 классе
Глава 4. Строение атома и периодичность изменения свойств атомов химических элементов и их соединений. Параграф 40. Характеристика химического элемента по его положению в периодической системе - страница 171.
Практическая работа 3 (с. 171)
Условие. Практическая работа 3 (с. 171)
скриншот условия

Практическая работа 3. Изучение кислотно-основных свойств гидроксидов элементов 3-го периода
Цель работы: исследовать зависимость кислотно-основных свойств гидроксидов, образованных химическими элементами 3-го периода, от положения этих элементов в периодической системе.
Оборудование и реактивы: штатив для пробирок, пробирки. Растворы гидроксида натрия, хлорида (или сульфата) магния, хлорида (или сульфата) алюминия, серной кислоты, лакмуса, хлороводородная (соляная) кислота.
Соблюдайте правила безопасного поведения!
Выполнение работы
Задание 1. Исследование свойств гидроксидов элементов IA- и IIA-групп — натрия и магния.
В две пробирки налейте растворы: в первую — гидроксида натрия, во вторую — хлорида (или сульфата) магния. В пробирку с раствором соли магния осторожно, по каплям добавьте раствор щелочи до появления белого осадка гидроксида магния. Составьте уравнение соответствующей реакции.
В первую пробирку с раствором щелочи добавьте 2-3 капли раствора индикатора и обратите внимание на изменение его цвета. К содержимому обеих пробирок небольшими порциями прибавляйте соляную кислоту.
Результаты исследования занесите в таблицу, указав признаки химических реакций. Составьте уравнения реакций. Сделайте вывод о кислотно-основном характере гидроксидов натрия и магния.
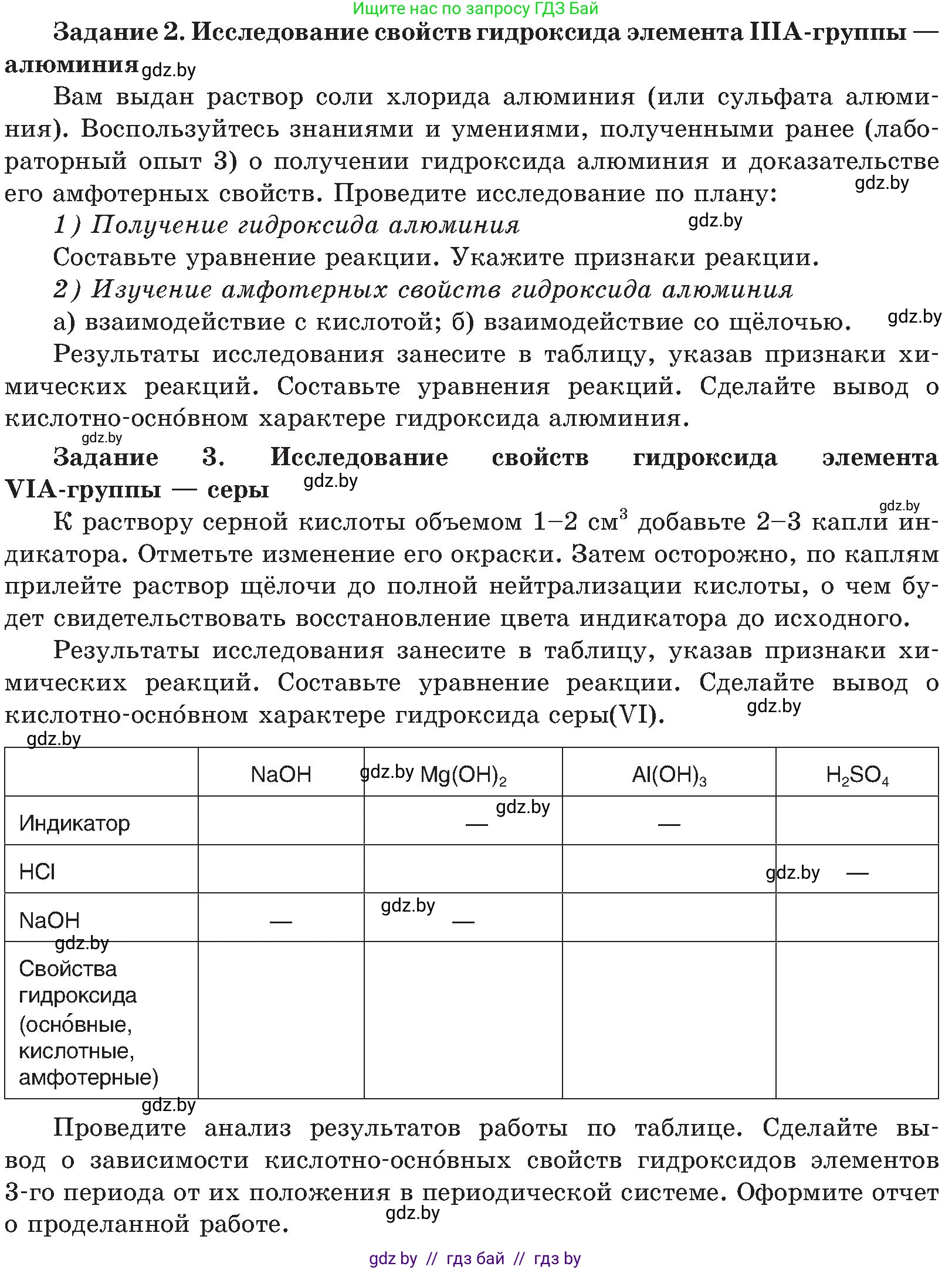
Задание 2. Исследование свойств гидроксида элемента IIIA-группы — алюминия
Вам выдан раствор соли хлорида алюминия (или сульфата алюминия). Воспользуйтесь знаниями и умениями, полученными ранее (лабораторный опыт 3) о получении гидроксида алюминия и доказательстве его амфотерных свойств. Проведите исследование по плану:
1) Получение гидроксида алюминия
Составьте уравнение реакции. Укажите признаки реакции.
2) Изучение амфотерных свойств гидроксида алюминия
а) взаимодействие с кислотой;
б) взаимодействие со щелочью.
Результаты исследования занесите в таблицу, указав признаки химических реакций. Составьте уравнения реакций. Сделайте вывод о кислотно-основном характере гидроксида алюминия.
Задание 3. Исследование свойств гидроксида элемента VIA-группы — серы
К раствору серной кислоты объемом 1–2 $cm^3$ добавьте 2–3 капли индикатора. Отметьте изменение его окраски. Затем осторожно, по каплям прилейте раствор щелочи до полной нейтрализации кислоты, о чем будет свидетельствовать восстановление цвета индикатора до исходного.
Результаты исследования занесите в таблицу, указав признаки химических реакций. Составьте уравнения реакций. Сделайте вывод о кислотно-основном характере гидроксида серы(VI).
| $NaOH$ | $Mg(OH)_2$ | $Al(OH)_3$ | $H_2SO_4$ | |
| Индикатор | — | — | — | — |
| $HCl$ | — | |||
| $NaOH$ | — | — | ||
| Свойства гидроксида (основные, кислотные, амфотерные) |
Проведите анализ результатов работы по таблице. Сделайте вывод о зависимости кислотно-основных свойств гидроксидов элементов 3-го периода от их положения в периодической системе. Оформите отчет о проделанной работе.
Решение. Практическая работа 3 (с. 171)

Решение 2. Практическая работа 3 (с. 171)
Практическая работа 3
Цель работы: исследовать зависимость кислотно-основных свойств гидроксидов, образованных химическими элементами 3-го периода, от положения этих элементов в периодической системе.
Оборудование и реактивы: штатив для пробирок, пробирки, растворы гидроксида натрия, хлорида (или сульфата) магния, хлорида (или сульфата) алюминия, серной кислоты, лакмуса, хлороводородной (соляной) кислоты.
Выполнение работы
Задание 1. Исследование свойств гидроксидов элементов IA- и IIA-групп — натрия и магния.
Решение:
1. Получаем гидроксид магния. В пробирку с раствором соли магния (хлорида магния $MgCl_2$) по каплям добавляем раствор гидроксида натрия ($NaOH$) до образования белого творожистого осадка гидроксида магния ($Mg(OH)_2$).
Уравнение реакции:
$MgCl_2 + 2NaOH \rightarrow Mg(OH)_2\downarrow + 2NaCl$
2. В другую пробирку с раствором гидроксида натрия ($NaOH$) добавляем 2-3 капли индикатора лакмуса. Раствор окрашивается в синий цвет, что свидетельствует о щелочной среде.
3. К раствору $NaOH$ с индикатором добавляем по каплям соляную кислоту ($HCl$). Наблюдаем исчезновение синей окраски (нейтрализацию).
Уравнение реакции:
$NaOH + HCl \rightarrow NaCl + H_2O$
4. К осадку гидроксида магния ($Mg(OH)_2$) добавляем соляную кислоту ($HCl$). Наблюдаем растворение осадка.
Уравнение реакции:
$Mg(OH)_2 + 2HCl \rightarrow MgCl_2 + 2H_2O$
Вывод: Гидроксид натрия является сильным основанием (щёлочью), а гидроксид магния — слабым, нерастворимым в воде основанием. Оба проявляют основные свойства, реагируя с кислотой.
Ответ: Гидроксид натрия и гидроксид магния являются основаниями.
Задание 2. Исследование свойств гидроксида элемента IIIA-группы — алюминия.
Решение:
1 ) Получение гидроксида алюминия
В пробирку с раствором соли алюминия (хлорида алюминия $AlCl_3$) добавляем по каплям раствор щёлочи ($NaOH$) до образования белого студенистого осадка гидроксида алюминия ($Al(OH)_3$). Важно не добавлять избыток щёлочи.
Признак реакции: образование белого студенистого осадка.
Уравнение реакции:
$AlCl_3 + 3NaOH \rightarrow Al(OH)_3\downarrow + 3NaCl$
2 ) Изучение амфотерных свойств гидроксида алюминия
Полученный осадок делим на две пробирки.
а) взаимодействие с кислотой: В первую пробирку с осадком добавляем соляную кислоту ($HCl$). Осадок растворяется.
Уравнение реакции:
$Al(OH)_3 + 3HCl \rightarrow AlCl_3 + 3H_2O$
Это доказывает наличие у гидроксида алюминия основных свойств.
б) взаимодействие со щёлочью: Во вторую пробирку с осадком добавляем избыток раствора гидроксида натрия ($NaOH$). Осадок растворяется.
Уравнение реакции:
$Al(OH)_3 + NaOH \rightarrow Na[Al(OH)_4]$ (образуется тетрагидроксоалюминат натрия)
Это доказывает наличие у гидроксида алюминия кислотных свойств.
Вывод: Гидроксид алюминия реагирует и с кислотами, и с щелочами, следовательно, он является амфотерным гидроксидом.
Ответ: Гидроксид алюминия проявляет амфотерные свойства.
Задание 3. Исследование свойств гидроксида элемента VIA-группы — серы.
Решение:
Гидроксидом, соответствующим высшей степени окисления серы (+6), является серная кислота ($H_2SO_4$).
1. В пробирку с раствором серной кислоты ($H_2SO_4$) добавляем 2-3 капли индикатора лакмуса. Раствор окрашивается в красный цвет, что свидетельствует о кислотной среде.
2. К полученному раствору по каплям приливаем раствор щёлочи ($NaOH$). Наблюдаем изменение окраски индикатора с красной на фиолетовую (нейтральная среда). Восстановление фиолетового цвета свидетельствует о полной нейтрализации кислоты.
Уравнение реакции:
$H_2SO_4 + 2NaOH \rightarrow Na_2SO_4 + 2H_2O$
Вывод: Серная кислота проявляет ярко выраженные кислотные свойства, реагируя с основанием.
Ответ: Гидроксид серы(VI) — серная кислота — является сильной кислотой.
Результаты исследований
| Реагент | NaOH | Mg(OH)₂ | Al(OH)₃ | H₂SO₄ |
|---|---|---|---|---|
| Индикатор | Изменение окраски на щелочную (лакмус - синий) | — | — | Изменение окраски на кислотную (лакмус - красный) |
| HCl | Нейтрализация, исчезновение синей окраски индикатора | Растворение белого осадка | Растворение белого студенистого осадка | — |
| NaOH | — | — | Растворение белого студенистого осадка | Нейтрализация, изменение окраски индикатора с красной на фиолетовую |
| Свойства гидроксида (основные, кислотные, амфотерные) | Основные (щёлочь) | Основные | Амфотерные | Кислотные |
Анализ результатов и общий вывод
Решение:
В ходе выполнения практической работы были исследованы кислотно-основные свойства гидроксидов элементов 3-го периода: натрия ($NaOH$), магния ($Mg(OH)_2$), алюминия ($Al(OH)_3$) и серы ($H_2SO_4$). На основе проведенных опытов можно сделать следующий вывод о зависимости свойств гидроксидов от положения образующих их элементов в периодической системе:
При движении слева направо по 3-му периоду периодической системы Д.И. Менделеева происходит ослабление металлических свойств элементов и усиление неметаллических. Это напрямую отражается на свойствах их высших гидроксидов:
- Натрий (Na), типичный металл IA-группы, образует сильное основание (щёлочь) — $NaOH$.
- Магний (Mg), металл IIA-группы, образует основание $Mg(OH)_2$, менее сильное, чем $NaOH$, и нерастворимое в воде.
- Алюминий (Al), металл IIIA-группы, проявляет переходные свойства и образует амфотерный гидроксид $Al(OH)_3$, который реагирует как с кислотами, так и с щелочами.
- Сера (S), неметалл VIA-группы, в высшей степени окисления образует сильную кислоту — $H_2SO_4$.
Таким образом, в пределах одного периода с увеличением порядкового номера элемента (и заряда ядра его атома) основные свойства гидроксидов ослабевают, а кислотные — усиливаются. Происходит закономерный переход от сильных оснований через амфотерные гидроксиды к сильным кислотам.
Ответ: Слева направо по 3-му периоду основные свойства гидроксидов ослабевают, а кислотные усиливаются, что связано с усилением неметаллических и ослаблением металлических свойств элементов.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения Практическая работа 3 расположенного на странице 171 к учебнику 2024 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению Практическая работа 3 (с. 171), авторов: Шиманович (Игорь Евгеньевич), Красицкий (Василий Анатольевич), Сечко (Ольга Ивановна), Хвалюк (Виктор Николаевич), учебного пособия издательства Адукацыя i выхаванне.













