Номер 6, страница 170 - гдз по химии 8 класс учебник Шиманович, Красицкий

Авторы: Шиманович И. Е., Красицкий В. А., Сечко О. И., Хвалюк В. Н.
Тип: Учебник
Издательство: Адукацыя i выхаванне
Год издания: 2024 - 2025
Цвет обложки: синий, розовый с таблицей Менделеева
ISBN: 978-985-03-2941-7
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 8 классе
Глава 4. Строение атома и периодичность изменения свойств атомов химических элементов и их соединений. Параграф 40. Характеристика химического элемента по его положению в периодической системе - номер 6, страница 170.
№6 (с. 170)
Условие. №6 (с. 170)
скриншот условия
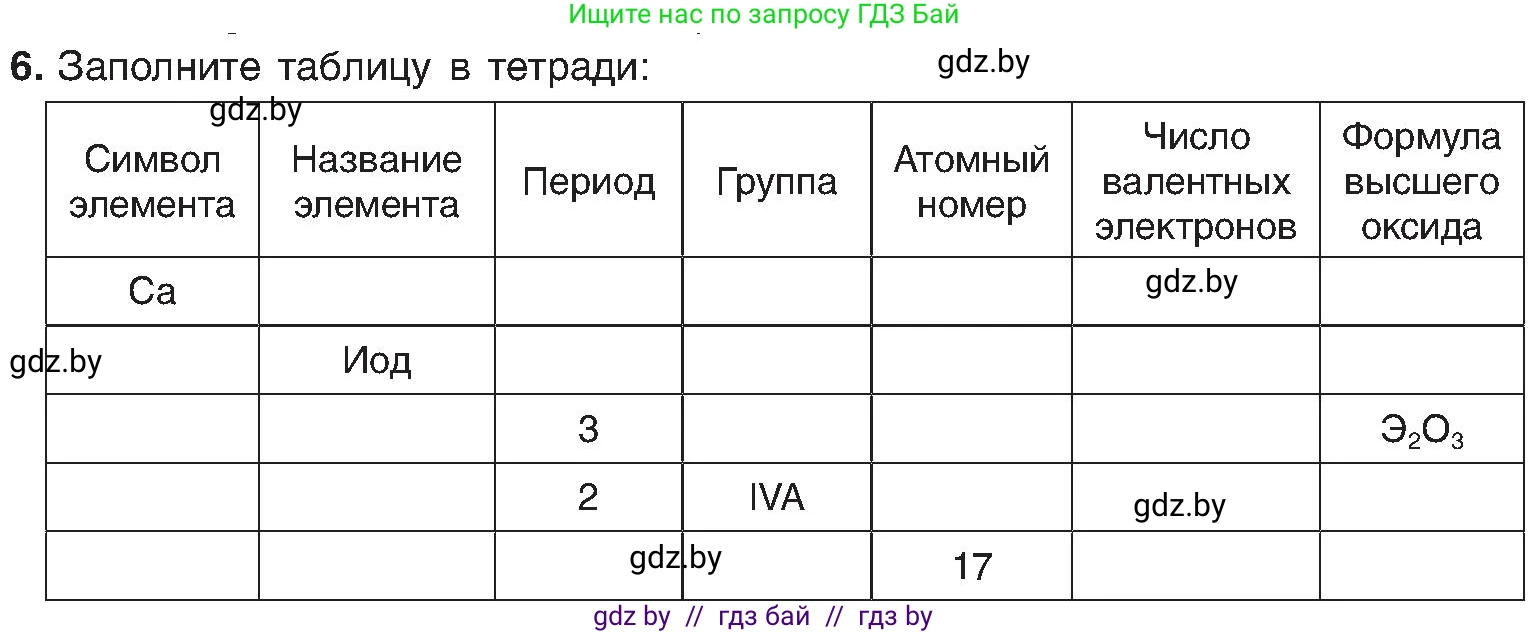
6. Заполните таблицу в тетради:
| Символ элемента | Название элемента | Период | Группа | Атомный номер | Число валентных электронов | Формула высшего оксида |
| Ca | ||||||
| Иод | ||||||
| 3 | $Э_2О_3$ | |||||
| 2 | IVA | |||||
| 17 |
Решение. №6 (с. 170)

Решение 2. №6 (с. 170)
Строка 1 (Символ элемента: Ca)
Решение:
На основании символа элемента "Ca" (Кальций) и его положения в Периодической системе химических элементов Д.И. Менделеева определяем остальные характеристики:
1. Название элемента: Ca – это Кальций.
2. Период и Группа: Кальций расположен в 4-м периоде и во II группе, главной подгруппе (IIA).
3. Атомный номер: Порядковый номер Кальция – 20.
4. Число валентных электронов: Для элементов главных подгрупп число валентных электронов равно номеру группы. Для Кальция (IIA группа) это число равно 2.
5. Формула высшего оксида: Высшая степень окисления Кальция равна +2 (соответствует номеру группы). Степень окисления кислорода в оксидах –2. Следовательно, формула высшего оксида – CaO.
Ответ: Название элемента – Кальций, Период – 4, Группа – IIA, Атомный номер – 20, Число валентных электронов – 2, Формула высшего оксида – CaO.
Строка 2 (Название элемента: Иод)
Решение:
На основании названия элемента "Иод" и его положения в Периодической системе определяем остальные характеристики:
1. Символ элемента: Химический символ Иода – I.
2. Период и Группа: Иод расположен в 5-м периоде и в VII группе, главной подгруппе (VIIA).
3. Атомный номер: Порядковый номер Иода – 53.
4. Число валентных электронов: Иод находится в VIIA группе, следовательно, у него 7 валентных электронов.
5. Формула высшего оксида: Высшая степень окисления Иода равна +7. Степень окисления кислорода –2. Для составления формулы находим наименьшее общее кратное для степеней окисления (14). Получаем формулу $I_2O_7$.
Ответ: Символ элемента – I, Период – 5, Группа – VIIA, Атомный номер – 53, Число валентных электронов – 7, Формула высшего оксида – $I_2O_7$.
Строка 3 (Период: 3, Формула высшего оксида: $Э_2O_3$)
Решение:
На основании известных данных определяем элемент и его характеристики:
1. Группа: Из формулы высшего оксида $Э_2O_3$ можно определить степень окисления элемента Э. Так как у кислорода степень окисления –2, то суммарный отрицательный заряд равен $3 \times (-2) = -6$. Следовательно, суммарный положительный заряд двух атомов Э равен +6, а степень окисления одного атома Э равна $+6 / 2 = +3$. Высшая степень окисления +3 характерна для элементов IIIA группы.
2. Элемент: Элемент, находящийся в 3-м периоде и IIIA группе, – это Алюминий (Al).
3. Характеристики: Атомный номер Алюминия – 13. Число валентных электронов равно номеру группы, то есть 3.
Ответ: Символ элемента – Al, Название элемента – Алюминий, Группа – IIIA, Атомный номер – 13, Число валентных электронов – 3.
Строка 4 (Период: 2, Группа: IVA)
Решение:
На основании известных данных определяем элемент и его характеристики:
1. Элемент: Элемент, расположенный во 2-м периоде и в IV группе, главной подгруппе (IVA), – это Углерод (C).
2. Характеристики: Название элемента – Углерод. Атомный номер – 6. Число валентных электронов равно номеру группы, то есть 4.
3. Формула высшего оксида: Высшая степень окисления Углерода +4. Степень окисления кислорода –2. Формула высшего оксида – $CO_2$.
Ответ: Символ элемента – C, Название элемента – Углерод, Атомный номер – 6, Число валентных электронов – 4, Формула высшего оксида – $CO_2$.
Строка 5 (Атомный номер: 17)
Решение:
На основании атомного номера определяем элемент и все его характеристики:
1. Элемент: Элемент с атомным номером 17 – это Хлор (Cl).
2. Характеристики: Название элемента – Хлор. Он расположен в 3-м периоде и в VII группе, главной подгруппе (VIIA).
3. Число валентных электронов: Хлор находится в VIIA группе, значит, у него 7 валентных электронов.
4. Формула высшего оксида: Высшая степень окисления Хлора равна +7. Степень окисления кислорода –2. Формула высшего оксида – $Cl_2O_7$.
Ответ: Символ элемента – Cl, Название элемента – Хлор, Период – 3, Группа – VIIA, Число валентных электронов – 7, Формула высшего оксида – $Cl_2O_7$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 6 расположенного на странице 170 к учебнику 2024 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №6 (с. 170), авторов: Шиманович (Игорь Евгеньевич), Красицкий (Василий Анатольевич), Сечко (Ольга Ивановна), Хвалюк (Виктор Николаевич), учебного пособия издательства Адукацыя i выхаванне.













