Номер 6, страница 131 - гдз по химии 8 класс учебник Шиманович, Красицкий

Авторы: Шиманович И. Е., Красицкий В. А., Сечко О. И., Хвалюк В. Н.
Тип: Учебник
Издательство: Адукацыя i выхаванне
Год издания: 2024 - 2025
Цвет обложки: синий, розовый с таблицей Менделеева
ISBN: 978-985-03-2941-7
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 8 классе
Глава 3. Периодический закон и периодическая система химических элементов. Параграф 30. Естественные семейства элементов - номер 6, страница 131.
№6 (с. 131)
Условие. №6 (с. 131)
скриншот условия
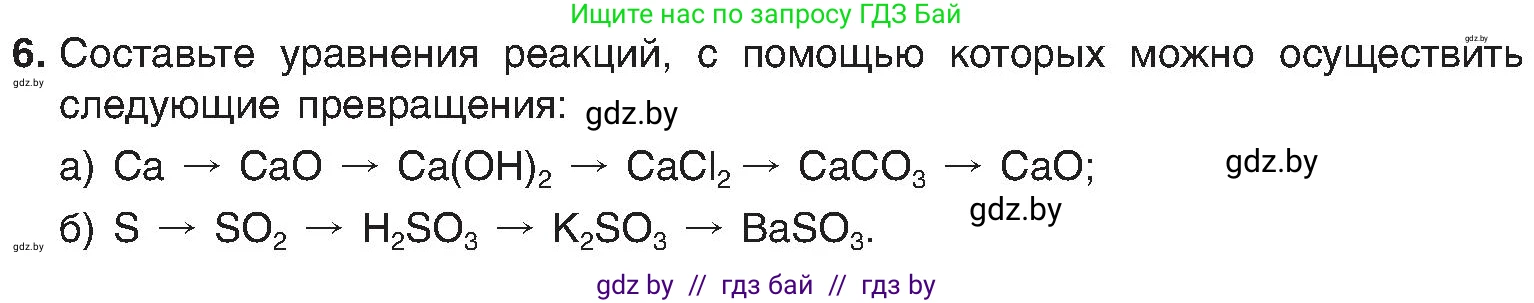
6. Составьте уравнения реакций, с помощью которых можно осуществить следующие превращения:
a) $Ca \to CaO \to Ca(OH)_{2} \to CaCl_{2} \to CaCO_{3} \to CaO;$
б) $S \to SO_{2} \to H_{2}SO_{3} \to K_{2}SO_{3} \to BaSO_{3}.$
Решение. №6 (с. 131)
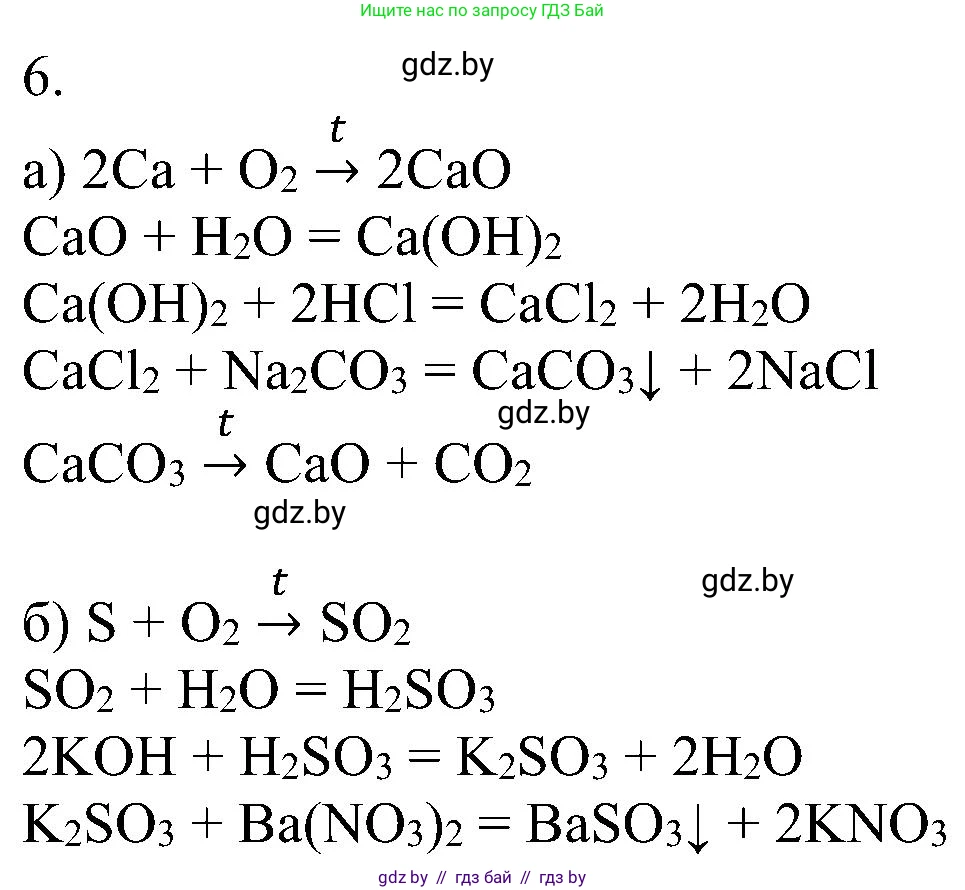
Решение 2. №6 (с. 131)
а) $Ca \rightarrow CaO \rightarrow Ca(OH)_2 \rightarrow CaCl_2 \rightarrow CaCO_3 \rightarrow CaO$;
Для осуществления данной цепочки превращений необходимо провести следующие реакции:
1. Получение оксида кальция $CaO$ из металлического кальция $Ca$. Этого можно достичь путем окисления кальция кислородом при нагревании (горение):
$2Ca + O_2 \rightarrow 2CaO$
2. Получение гидроксида кальция $Ca(OH)_2$ из оксида кальция $CaO$. Оксид кальция является основным оксидом и активно реагирует с водой, образуя соответствующее основание (гашёную известь):
$CaO + H_2O \rightarrow Ca(OH)_2$
3. Получение хлорида кальция $CaCl_2$ из гидроксида кальция $Ca(OH)_2$. Это реакция нейтрализации, в которой основание реагирует с кислотой. В данном случае используем соляную кислоту $HCl$:
$Ca(OH)_2 + 2HCl \rightarrow CaCl_2 + 2H_2O$
4. Получение карбоната кальция $CaCO_3$ из хлорида кальция $CaCl_2$. Так как карбонат кальция является нерастворимой солью, его можно получить реакцией обмена, добавив к раствору хлорида кальция раствор другой соли, содержащей карбонат-ион, например, карбоната натрия $Na_2CO_3$. $CaCO_3$ выпадет в виде белого осадка:
$CaCl_2 + Na_2CO_3 \rightarrow CaCO_3 \downarrow + 2NaCl$
5. Получение оксида кальция $CaO$ из карбоната кальция $CaCO_3$. Это промышленный способ получения негашёной извести, который заключается в термическом разложении карбоната кальция при прокаливании:
$CaCO_3 \xrightarrow{t^\circ} CaO + CO_2 \uparrow$
Ответ:
$2Ca + O_2 \rightarrow 2CaO$
$CaO + H_2O \rightarrow Ca(OH)_2$
$Ca(OH)_2 + 2HCl \rightarrow CaCl_2 + 2H_2O$
$CaCl_2 + Na_2CO_3 \rightarrow CaCO_3 \downarrow + 2NaCl$
$CaCO_3 \xrightarrow{t^\circ} CaO + CO_2 \uparrow$
б) $S \rightarrow SO_2 \rightarrow H_2SO_3 \rightarrow K_2SO_3 \rightarrow BaSO_3$;
Для осуществления данной цепочки превращений необходимо провести следующие реакции:
1. Получение диоксида серы $SO_2$ из серы $S$. Диоксид серы, или сернистый газ, образуется при сжигании серы в кислороде:
$S + O_2 \xrightarrow{t^\circ} SO_2$
2. Получение сернистой кислоты $H_2SO_3$ из диоксида серы $SO_2$. Диоксид серы является кислотным оксидом, который при растворении в воде образует соответствующую кислоту — сернистую. Реакция является обратимой, так как сернистая кислота неустойчива:
$SO_2 + H_2O \rightleftharpoons H_2SO_3$
3. Получение сульфита калия $K_2SO_3$ из сернистой кислоты $H_2SO_3$. Для получения соли необходимо провести реакцию нейтрализации кислоты основанием. Используем гидроксид калия $KOH$:
$H_2SO_3 + 2KOH \rightarrow K_2SO_3 + 2H_2O$
4. Получение сульфита бария $BaSO_3$ из сульфита калия $K_2SO_3$. Сульфит бария — нерастворимая соль. Ее можно получить с помощью реакции ионного обмена, добавив к раствору сульфита калия раствор растворимой соли бария, например, хлорида бария $BaCl_2$. Сульфит бария выпадет в осадок:
$K_2SO_3 + BaCl_2 \rightarrow BaSO_3 \downarrow + 2KCl$
Ответ:
$S + O_2 \xrightarrow{t^\circ} SO_2$
$SO_2 + H_2O \rightleftharpoons H_2SO_3$
$H_2SO_3 + 2KOH \rightarrow K_2SO_3 + 2H_2O$
$K_2SO_3 + BaCl_2 \rightarrow BaSO_3 \downarrow + 2KCl$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 6 расположенного на странице 131 к учебнику 2024 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №6 (с. 131), авторов: Шиманович (Игорь Евгеньевич), Красицкий (Василий Анатольевич), Сечко (Ольга Ивановна), Хвалюк (Виктор Николаевич), учебного пособия издательства Адукацыя i выхаванне.













